Grundlagenwissen Die 10 wichtigsten Medizintechnik-Normen: Entstehung, Vorteile, Anwendung
Normen werden je nach Standpunkt geliebt oder gehasst. Aber wie entstehen eigentlich Normen? Und was sind die Vorteile von Normen? Aber vor allem: Was sind die zehn wichtigsten Normen für Hersteller von Medizinprodukten?
Anbieter zum Thema

Funktioniert ein Gerät in der Medizintechnik nicht korrekt oder überhaupt nicht, kann dies weitreichende Folgen haben. Um dies zu verhindern, wurden spezifische Normen und damit einhergehend auch Zulassungsverfahren entwickelt. Im Folgenden wird der Begriff „Norm“ in der Medizintechnik definiert, und es wird erläutert, welchen Zweck Normen haben. Zudem wird zwischen Prozess- und Qualitätsnormen differenziert. Die zehn wichtigsten Normen in der Medizintechnik werden kurz vorgestellt. Wichtig in diesem Zusammenhang ist auch zu wissen: Was ist Medizintechnik? Definition, Beispiele und Karriere!
Was sind Normen und wie entstehen sie?
Bei einer Norm handelt es sich um eine anerkannte Regel der Technik, die von Experten im Zuge eines Konsensverfahrens erstellt wird. Der Ablauf ist wie folgt:
- Normungsantrag: Ein Normungsantrag kann von jedermann beim Deutschen Institut für Normung (DIN) gestellt werden
- Experten-Prüfung, ob Interesse an der vorgeschlagenen Norm besteht und ein Projekt finanziert wird
- Aufsetzen eines Norm-Projektes
- Normen-Ausschuss-Sitzung
- Verabschiedung eines Norm-Entwurfs
- Veröffentlichung des Norm-Entwurfs: Die Öffentlichkeit hat nun zwei Monate Zeit, diesen zu kommentieren
- Beratung über eingegangene Veränderungsvorschläge
- Veröffentlichung der finalen Norm durch den Beuth-Verlag
Im Video: Jens Bauch, Projektmanager im Normenausschuss Sport- und Freizeitgeräte (NA Sport), erklärt an einem konkreten Beispiel, wie eine Norm entsteht.
Das DIN selbst entwickelt indes keine Normen. Vielmehr erfüllt das Institut ein Mandat der Bundesrepublik Deutschland. Die Aufgaben sind, alle für ein Thema relevanten Interessensgruppen zusammenzubringen und die Vertretung der deutschen Interessen in der europäischen und internationalen Normung. Anlässlich des 100. Geburtstages im März 2017 erklärt der Vorstandsvorsitzende Christoph Winterhalter die Rolle des DIN so: „Die treibenden Kräfte hinter Normung und Standardisierung sind Wirtschaft und Gesellschaft. Von ihnen kommen die Impulse zur Normung. Und zwar weil das Bedürfnis für eine entsprechende Norm besteht – sei es zur Qualitätssicherung von Produkten oder Dienstleistungen, um den Handel zu erleichtern, Innovationen zur Marktreife zu entwickeln oder um Zukunftsfelder zu erschließen. Wir orchestrieren den Dialog und sorgen dafür, dass die Interessen aller Stakeholder und relevante Schutzziele, beispielsweise im Hinblick auf den Verbraucher-, Umwelt- oder Arbeitsschutz, ausgewogen berücksichtigt werden.“

Entsprechend ist eine Norm eine technische Beschreibung, die für jedermann zugänglich ist und auf abgestimmten Ergebnissen von Wissenschaft, Praxis und Technik beruht. Eine Norm wird von einer anerkannten Organisation gebilligt:
- auf regionaler beziehungsweise nationaler Ebene vom Deutschen Institut für Normung (DIN)
- auf europäischer Ebene vom Europäischen Komitee für Normung (CEN), das verantwortlich ist für Europäische Normen (EN)
- auf internationaler Ebene zum Beispiel von der Internationalen Organisation für Normung (ISO) oder der Internationalen Elektrotechnischen Kommission (IEC)
Wichtigstes Normungsgremium im Bereich von Medizinprodukten ist der DIN-Normenausschuss Medizin (NAMed). Seine Zuständigkeit erstreckt sich nicht nur auf die nationale Normung, sondern er vertritt die Interessen deutscher Normung auch auf europäischer (CEN) und internationaler (ISO) Ebene. Dabei verfolgt er stets das Ziel, einen entscheidenden Beitrag für die Patientensicherheit zu leisten, indem er ein möglichst hohes Qualitätsniveau der genormten Produkte und Verfahren festschreibt.

Vor der Erstellung einer Norm werden auf Basis wissenschaftlicher Erkenntnisse spezifische Methoden und Verfahren zur Normierung und Zertifizierung entwickelt. Liegen diesbezüglich bereits beispielhafte technische Realisierungen vor, können diese natürlich auch herangezogen werden. Letztlich dienen Normen dazu, den sogenannten „Stand der Technik“ abzubilden. Zwar steht ihre Anwendung im Grunde jedermann frei, doch wird die Einhaltung von Normen nicht selten durch Rechts- und Verwaltungsvorschriften verbindlich vorgeschrieben.
In der Medizintechnik dienen Normen unter anderem dazu, die minimalen Anforderungen an Medizinprodukte zu definieren. Dabei sind Normen im medizinischen Bereich lange Zeit durch die Richtlinie 93/42/EWG über Medizinprodukte (Medical Device Directive, MDD) und die Richtlinie 90/385/EWG über aktive implantierbare Medizinprodukte (Active Implantable Medical Devices, AIMD) in ihrer Bedeutung aufgewertet worden, die durch das harmonisierte Medizinproduktegesetz (MPG) in deutsches Recht umgesetzt wurden.
Am 25. Mai 2017 ist an ihre Stelle die Europäische Medizinprodukteverordnung „Medical Device Regulation“ (MDR) getreten, die nach einer Übergangszeit von drei Jahren eigentlich ab dem 26. Mai 2020 gelten sollte. Die Übergangszeit wurde allerdings um ein weiteres Jahr verlängert und endet am 26. Mai 2021. Ab diesem Datum ist die neue MDR verbindlich anzuwenden. Die bisher geltende Richtlinie 98/79/EG über In-vitro-Diagnostika (IVD) ist dagegen nicht in der Medical Device Regulation aufgegangen. Sie wurde durch eine eigene neue EU-Verordnung ersetzt, die In-vitro Diagnostic Medical Devices Regulation (IVDR).
Mit anderen Worten: Normen in der Medizintechnik geben den Mindeststand der Technik wieder, den Produzenten medizinischer Produkte bei der Konzeption und Fertigung sowie in Bezug auf den Betrieb beziehungsweise die Anwendung der Produkte zu beachten haben.
:quality(80):fill(efefef,0)/images.vogel.de/vogelonline/bdb/1310000/1310082/original.jpg)
Vorteile von Normen
Grundsätzlich bieten Normen eine Reihe von Vorteilen für Akteure aller Branchen. Die wichtigsten sind:
- Einheitliche Standards und belegbare Nachweise von Normen geben Herstellern Orientierung und verhelfen diesen letztlich zu Wettbewerbsvorteilen.
- Der Bezug auf Normen bietet Rechtssicherheit in Verträgen.
- Normen dienen der Sicherheit – im Bereich von Medizinprodukten beispielsweise bei deren CE-Kennzeichnung im Rahmen der Zulassung.
- Das Produkthaftungsrisiko sinkt.
- Der Aufwand für die Dokumentation der Qualitätssicherung sinkt.
Normen für elektronische und mechanische Medizinprodukte
Ganz gleich ob im elektronischen oder mechanischen Bereich bilden Normen darüber hinaus die Basis dafür, dass Bauelemente medizinischer Systeme und Geräte miteinander kompatibel sind. Zudem wird durch Normen sichergestellt, dass die medizinischen Produkte über ihren gesamten Lebenszyklus hinweg zuverlässig arbeiten. Weitere Vorteile von Normen bestehen – und zwar auch, allerdings nicht ausschließlich im medizinischen Bereich – darin, dass durch ihre Einhaltung der freie Warenverkehr erleichtert und die streng regulierte Zulassung von medizinischen Systemen und Geräten weltweit vereinfacht wird. Siehe hierzu auch: Plädoyer fürs MDSAP: Fünf Länder, ein Prüfverfahren
In der Medizintechnik wird eine international gültige Norm für den elektrischen Bereich in der Regel von der IEC und für den mechanischen Bereich im Allgemeinen von der ISO erarbeitet und herausgegeben. Allerdings ist es heutzutage nicht immer einfach, ein Medizinprodukt eindeutig einem der beiden genannten Bereiche zuzuordnen. Dies liegt vor allem daran, dass moderne Medizinprodukte meist Systemcharakter aufweisen und immer komplexer werden. De facto ist der Systemcharakter jedoch Voraussetzung dafür, dass ein Medizinprodukt den kontinuierlich steigenden Anforderungen der medizinischen Diagnose sowie der medizinischen Therapie gerecht werden kann.
Die Entstehung von Produkt- und Prozessnormen in der Medizintechnik
Historischer Exkurs in die Entstehung von Produkt- und Prozessnormen in der Medizintechnik: Bereits seit dem Jahr 1910 finden sich Anhaltspunkte zur Normung von einzelnen Medizinprodukten. Damals handelte es sich vorrangig um technische Produkte wie Hochfrequenz-Chirurgiegeräte. Zudem waren die Normen zu dieser Zeit darauf ausgerichtet, physikalischen Gefährdungen wie beispielsweise einem Brand, einem elektrischen Schlag oder ähnlichem sowohl für Anwender als auch Patienten vorzubeugen.

In Folge wurden weitere medizinische Geräte zur Diagnose, zum Beispiel das Röntgengerät von Wilhelm Conrad Röntgen, einem Abgänger ohne Zeugnis, und Therapie, zum Beispiel Infusionspumpen, entwickelt, wobei für viele neue Medizinprodukte auch eine spezifische Norm erstellt wurde. Um die Vielzahl medizinischer Produkte abzudecken, wurde eine sogenannte Normungsfamilie gebildet, welche aus zwei Gruppen besteht. Bei diesen handelt es sich um die Folgenden:
- 1. allgemein gültige Vorgaben für eine Produktfamilie
- 2. Normen für spezifische Produkte, durch welche die Vorgaben unter (1) ergänzt oder modifiziert werden
Grundsätzlich ist diese Vorgehensweise beziehungsweise Untergliederung deshalb sinnvoll und effizient, weil nur ein geringer Aufwand notwendig ist, um etwaige produktspezifische Anpassungen vorzunehmen.
Technischer Aufbau versus Verfahren, Prozessen und Methoden
In Bezug auf Normen wird zudem zwischen zwei Bereichen differenziert:
- Normen zur Gestaltung des technischen Aufbaus, vor allem für elektrische Medizinprodukte, das heißt für Systeme und Geräte
- Normen zur Beschreibung von Verfahren, Prozessen oder Methoden, wobei unter diesen Bereich neben den Normen zum Risiko- auch diejenigen zum Qualitätsmanagement fallen
Aufgrund der Entwicklungen in der Medizintechnik in den letzten Jahren ist die Etablierung von Prozessnormen unerlässlich geworden. Sie ermöglichen die Risikobeherrschung von Medizinprodukten, welche aufgrund technischer Innovationen durch eine steigende Komplexität gekennzeichnet sind und deren Inbetriebnahme durch etwaige Kombination, Interaktion sowie Interkonnektivität risikobehafteter ist.
Die Qualitätsnormung bezieht sich dagegen auf den Prozess der Herstellung von Medizinprodukten, wobei durch das Risikomanagement mögliche Risiken für Patienten, Dritte und die Umwelt minimiert oder ausgeschlossen werden sollen.
Unternehmen, die ein Medizinprodukt herstellen, sollten beide Prozesse implementieren, um sicherzustellen, dass allen regulatorischen Forderungen Rechnung getragen wird. Anzumerken ist zudem, dass früher versucht wurde, eine strikte Trennung zwischen Produkt- und Prozessnormen zu erreichen. Mittlerweile ist man hiervon jedoch abgerückt und vertritt die These, dass sich beide Bereiche wechselseitig ergänzen.
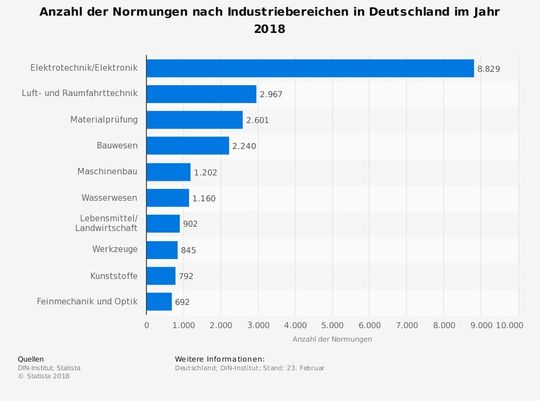
Die zehn wichtigsten Normen in der Medizintechnik im Überblick
- 1. DIN EN ISO 13485 – Medizinprodukte: Bei der DIN EN ISO 13485 handelt es sich um eine Norm, in der die Anforderungen für ein umfassendes Managementsystem in Bezug auf die Herstellung und das Design von medizinischen Produkten repräsentiert sind. In dieser Norm wurden frühere Normen wie die EN 46001 und EN 46002 sowie die ISO 13485 und ISO 13488 aus dem Jahr 1996 zusammengefasst und ergänzt. Auch in Deutschland steht diese Norm als DIN EN ISO 13485 zur Verfügung. Siehe hierzu auch: ISO 13485:2016: Neue Anforderungen für Medizinproduktehersteller.
Obschon es sich bei der DIN EN ISO 13485 um eine eigenständige Norm handelt, ist sie mit der DIN EN ISO 9001 in weiten Teilen deckungsgleich. Allerdings bezieht sich die DIN EN ISO 13485 vorrangig auf die Sicherheit von Medizinprodukten und die DIN EN ISO 9001 vordergründig auf das Qualitätsmanagement, das heißt die stetige Verbesserung der Organisation. Entsprechend sind in der DIN EN ISO 13485 die Anforderungen zur Herstellung sowie zum Inverkehrbringen von Medizinprodukten festgeschrieben.
- 2. ISO 9001 – Qualitätsmanagement: Das bereits erwähnte Pendant zur ISO 13485 ist die ISO 9001, wobei es sich bei dieser auch als Qualitätsmanagementnorm bezeichneten Norm um die bedeutendste und am weitesten verbreitete Norm im Bereich des Qualitätsmanagements (QM) handelt. Dabei zielt die Norm auf eine kontinuierliche Optimierung des unternehmenseigenen Qualitätsmanagementsystems (QMS) ab. Eine Zertifizierung nach DIN EN ISO 9001 ist für alle Organisationen und Unternehmen in allen Branchen, also nicht nur im medizinischen Bereich, möglich. Ein Taskboard unterstützt bei systematischer Aufgabenbearbeitung.
Inhaltlich bezieht sich diese Norm auf die Mindestanforderungen an ein firmeninternes Qualitätsmanagementsystem, um allen Anforderungen der Kunden sowie der Dienstleistungs- und Produktqualität gerecht zu werden. Dabei ist die Prozessorientierung ein essenzieller Grundsatz dieser Norm. De facto werden alle wichtigen betrieblichen Prozesse durch ein prozessorientiertes Qualitätsmanagementsystem begleitet und überprüft, so dass vorhandenes Optimierungspotenzial aufgedeckt werden kann.
- 3. DIN EN ISO 14155 – Klinische Prüfung medizinischer Produkte: Durch die DIN EN ISO 14155 – Klinische Prüfung von Medizinprodukten werden die formellen Anforderungen, welche in Bezug auf die Durchführung von klinischen Prüfungen existieren, definiert. Demnach zielt die Norm vorrangig darauf ab, Probanden, welche im Rahmen des Prüfverfahrens von medizinischen Produkten eingesetzt werden, zu schützen. Darüber hinaus dient die Norm dazu, zu gewährleisten, dass im Rahmen der Prüfung Ergebnisse entstehen, die wissenschaftlich fundiert sind.
Die ISO 14155 ist vor allem für Medizinprodukthersteller sowie für Institutionen und Ärzte von Relevanz, da diese im Zuge der klinischen Prüfungen medizinischer Produkte tätig werden. Erstellt wurde die europäische Norm in Zusammenarbeit des CEN/TC „Klinische Untersuchung von medizinischen Geräten“ und des ISO/TC „Biologische Beurteilung von Medizinprodukten“, wobei auch deutsche Experten involviert waren. Im Deutschen Institut für Normung war für diese Norm der Arbeitsausschluss „Klinische Prüfungen“ zuständig.
- 4. ISO 14971 – Risikomanagement medizinischer Produkte: Folgt man der Europäischen Richtlinie 93/42/EWG beziehungsweise seit Mai 2018 der Medical Device Regulation (MDR) sowie dem Medizinproduktegesetz, muss das Risikomanagement als eine zwingende Voraussetzung für ein Medizinprodukt angesehen werden. Durch die DIN EN ISO 14971 wird das Risikomanagement jedoch nicht nur in Bezug auf medizinische Produkte geregelt, welche für den europäischen Markt bestimmt sind, sondern auch für diejenigen des Weltmarktes, das heißt auch für den nordamerikanischen Markt.
Die Norm umfasst dabei neben der Risikoanalyse auch die Risikobewertung sowie die Risikobeherrschung durch das Maßnahmen-Management über eine Neubewertung, nachdem die entsprechenden Maßnahmen durchgeführt wurden bis hin zur Beobachtung des Marktes, nach Platzierung des Produktes und – falls notwendig – ein erneutes Risikomanagement. Durch die DIN EN ISO 14971 wurden die entsprechenden Vorgängernormen DIN EN 1441 bezüglich der Risikoanalyse von Medizinprodukten sowie ein Teil der DIN EN 60601-1-1-4, in dem es um das Risikomanagement geht, ersetzt. Die Frage ist: Hat man damit wirklich alles im Griff?
Kostenloses Whitepaper: Verbesserung des Risikomanagements für Medizinprodukte
Grundsätzlich zielt die DIN EN ISO 14971 darauf ab, potenzielle Risiken durch konstruktive oder konzeptionelle Maßnahmen zu minimieren oder zu beseitigen. Ist eine Minimierung oder Beseitigung der Risiken nicht möglich, gilt es, entsprechende Maßnahmen zum Schutz zu ergreifen. Die letzte Möglichkeit besteht in der Unterrichtung der Anwender der Medizinprodukte über etwaige Restrisiken in Form von Warnhinweisen. Dabei gilt: Nicht auszuschließende Restrisiken bei der Produktanwendung müssen im Vergleich zum Nutzen der Wirkung vertretbar und in hohem Maßen auch mit dem Schutz von Sicherheit und Gesundheit vereinbar sein.
- 5. IEC 60601 – Medizinische elektrische Geräte: Bei der IEC 60601 handelt es sich um eine Normenreihe, in welcher einerseits die Anforderungen an die Sicherheit und andererseits ergonomische Forderungen an elektrische Medizingeräte sowie Medizinsysteme festgeschrieben sind. In Deutschland ist das Deutsche Institut für Normung (DIN) für die Herausgabe zuständig. In Bezug auf diese Normenreihe wird zwischen der Basisnorm EN 60601-1 und Ergänzungsnormen sowie besonderen Festlegungen differenziert. Sieh hierzu auch:
– Die 3. Ausgabe der 60601-1 erfolgreich umsetzen
– Licht im Normen-Dschungel
Im Rahmen der Basisnorm werden die Kriterien für die Basissicherheit sowie die grundlegenden Leistungsmerkmale elektrischer medizinischer Geräte und elektrischer medizinischer System definiert. Diese Medizingeräte und Medizinsysteme stehen in einem elektrischen oder körperlichen Kontakt mit dem Patienten und übertragen Energie vom oder zum Patienten. Die Basisnorm EN 60601-1 dient als Grundlage für die spezifischen Festlegungen. Zudem existieren etwa zehn Ergänzungsnormen, welche jeweils auf eine bestimmte Untergruppe aller medizinischen Produkte anwendbar sind.
- 6. IEC 62133 – Aufladbare Akkumulatoren und Batterien: Die EC 62133-1:2017 und IEC 62133-2:2017 enthalten Anforderungen und Regelungen für den Betrieb gasdichter Akkumulatoren und Batterien, welche in tragbaren Geräten verwendet werden und über alkalische oder andere nicht säurehaltige Elektrolyte verfügen. Die Normen umfassen und definieren die Anforderungen und Prüfungen, die für einen sicheren Betrieb notwendig sind. Mit zunehmender Verbreitung sogenannter Wearables wächst auch die Bedeutung dieser Norm.
- 7. IEC 60086-4 – Lithium-Batterien: Grundsätzlich besteht der Unterschied zwischen Lithium-Batterien und herkömmlichen Primärbatterien, welche über wässriges Elektrolyt verfügen, darin, dass Lithium-Batterien brennbare Stoffe enthalten. Aus diesem Grund müssen in Bezug auf alle Bereiche, das heißt von der Herstellung über den Vertrieb, die Nutzung und Wartung bis zur Entsorgung, spezifische Sicherheitsvorkehrungen im Umgang mit Lithium-Batterien eingehalten werden. In der Norm IEC 60086-4 werden sowohl die Anforderungen als auch die Prüfungen für Lithium-Primärbatterien definiert, so dass bei bestimmungsgemäßer Verwendung sowie einer vernünftigerweise vorhersehbaren Fehlanwendung ein sicherer Betrieb garantiert ist. Wird das missachtet, drohen Medizinprodukte-Herstellern, drastische Maßnahmen, wie zum Beispiel ein FDA-Rückruf wegen vorzeitig entladener Batterien.
- 8. DIN 58298 – Fachgrundnorm für medizinische Instrumente: Bei der DIN 58298 handelt es sich um eine Fachgrundnorm für Medizininstrumente, die im Gesundheitswesen Anwendung finden. Durch die Norm werden der Werkstoff und die Ausführung sowie die Prüfung medizinischer Instrumente beschrieben. Grundsätzlich besitzt die DIN 58298 Gültigkeit für diejenigen Medizininstrumente, in deren spezifischer Produktnorm auf die DIN 58298 verwiesen wird. Dabei wird auch für nicht genormte Medizininstrumente die Anwendung dieser Norm empfohlen – dies natürlich nur, insofern sie einer Instrumentengruppe zuordenbar sind. Zudem gilt, dass sowohl in den Unterlagen zur Bestellung als auch der Lieferung auf die Fachgrundnorm DIN 58298 hinzuweisen ist. Zielgruppe der Norm sind Hersteller von Medizininstrumenten. Die DIN 58298 wirkt aufgrund der Auflistung der meistverwendeten Werkstoffe kostenreduzierend.
- 9. DIN EN ISO 22870 – Patientennahe Untersuchungen (POCT): Im Rahmen der DIN EN ISO 22870 sind die Anforderungen definiert, die für patientennahe Untersuchungen Gültigkeit besitzen. Dabei ist die Anwendung der Norm in Kombination mit ISO 15189 bestimmt. Die DIN EN ISO 22870 gilt dann, wenn Point-of-Care-Testing (POCT) in einem Krankenhaus, einer Ambulanz oder aber einer Pflegeorganisation angewendet wird, in der eine ambulante Patientenversorgung stattfindet. Der Anwendungsbereich der DIN EN ISO 22870 erstreckt sich von transkutanen Messungen über die Ausatemluftanalyse bis zur In-vivo-Überwachung von physiologischen Parametern.
- 10. DIN EN ISO 23640 – In-vitro-Diagnostika: Der Gültigkeitsbereich der DIN EN ISO 23640 bezieht sich auf die Haltbarkeitsprüfung von Reagenzien, die im Rahmen von In-vitro-diagnostischen Untersuchungen eingesetzt werden, inklusive Kalibratoren, Reagenzprodukten sowie Materialien zur Kontrolle und Kits. Denn: „Ohne vernünftige Diagnostik bleibt man blind“. Durch die DIN EN ISO 23640 werden die allgemeinen Anforderungen für die Haltbarkeitsprüfung definiert, wobei sie auch an die beschleunigte Prüfung sowie die Echtzeitprüfung zur Gewinnung von Daten zur Haltbarkeitsdauer spezifische Anforderungen enthält. Hierzu gehören:
– die Haltbarkeitsdauer der Reagenzien inklusive ihrer Transporthaltbarkeit
– die Haltbarkeitsdauer der Reagenzien nach dem ersten Öffnen des jeweiligen Primärbehältnisses
– die Haltbarkeitsdauer der Reagenzien von bereits im Verkehr befindlichen Reagenzien
Weiterführende Links
Beuth-Verlag
:quality(80)/images.vogel.de/vogelonline/bdb/1353500/1353524/original.jpg)
Grundlagenwissen
Was ist Medizintechnik? Definition, Beispiele und Karriere!
:quality(80)/images.vogel.de/vogelonline/bdb/1346000/1346013/original.jpg)
Industrieverband Spectaris
„Protektionismus hat fatale Folgen für den Standort Deutschland“
Und jetzt sind Sie dran!
Geben Sie Feedback zu diesem Artikel. Welche Fragen sind noch offen, welche Aspekte interessieren Sie? Mit Ihrem Kommentar helfen Sie, den Artikel noch besser zu machen.
* Romy Schmidt, Wissenschaftsjournalistin
(ID:45220376)





:quality(80)/p7i.vogel.de/wcms/16/d3/16d3e08f9404aae1cec19cf11f471e27/0126703504v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/85/9b/859b80e75b3413924fd3881780aafcb5/0129233903v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/fd/9e/fd9e58bc65419bb1c548956dcf9d4a72/pxl-20250616-161225541-mp-4032x2266v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/75/1f/751f88c67304422adb41b4b483cb380a/0129165554v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/45/b6/45b65a524779a2a78a6970f934d2e393/0129192749v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/41/3a/413a8efd1c15d4c689ca68fe990ba23e/0129177023v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/2a/3c/2a3ce942991f49f7181575902d1c2402/0129153972v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/bb/65/bb65555313afaeea9b670d972f46bddf/0129082573v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/72/19/72191feefa6b3e362750e4a4793ccc1d/0128875426v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/54/85/54853fc5f453b9ea45dd1c77a5498489/0128960394v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/ae/95/ae95789eaff136071ae1a73f7b53f2b0/0129146799v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/83/06/83065886248e8b9dc56b1a2695a8543c/0129053987v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/8a/8a/8a8a9fcb0c27d5e06522395cfb0f5498/0129165418v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/6c/a1/6ca16dd88171fbbefde3f57b54d0b01f/0129128416v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/d4/0b/d40b7ac0301a768e60b106315a523344/0129232430v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/98/c5/98c59e862c4e53ff570d190ad6dd2f97/0129073317v2.jpeg)
:fill(fff,0)/p7i.vogel.de/companies/68/df/68df892ad58b4/prosmap-logo-tagline-vertical-1c.png)
:fill(fff,0)/p7i.vogel.de/companies/5f/b6/5fb69cb5dff5e/metecon-logo-rgb-300dpi.jpg)
:fill(fff,0)/p7i.vogel.de/companies/67/60/676050c92dbbf/codialist-logo-weisse-schrift-rgb-square--3-.png)

:quality(80)/p7i.vogel.de/wcms/de/fa/default_article/default-article-image.jpeg)
:quality(80)/p7i.vogel.de/wcms/e1/28/e128a16ce54d8f4038a94a09b2a1e8ae/0127014673v2.jpeg)